Un peu de chimie (youpi!): les mystères du pH n'en seront bientôt plus (suffit d'être courageux)
Dites, je remarque qu'on ne parle plus chimie depuis longtemps, par ici... Pas bien!
Parce qu'après tout, s'amuser à saponifier, c'est bien, comprendre les mécanismes scientifiques qui entrent en jeu, c'est mieux... Non? Ah? Bon.
Ben tant pis, hein. Je vais quand même faire ma professeur-à-frange-de-2-sous, na.
Parce que moi, ben la chimie, ça me manque beaucoup, tu sais... Là où je travaille, dorénavant, les distillations ne sont plus qu'un lointain souvenir (ému), et les équations d'oxydo-réduction n'ont plus vraiment leur place dans mes activités quotidiennes...
(je t'ai dit que je faisais des microcapteurs de gaz, là où je suis? Ben voilà, tu sais tout).
(le capteur à dioxyde de carbone, je te l'accorde, c'est moins glamour que l'extraction par solvant des concrètes de fleurs... Mais voilà, je me venge en plongeant tout composé odorant dans de l'alcool à 90° pour compenser un peu et me rappeler mes jeunes années. Et toc).
(et en plus, j'obtient de belles teintures parfumées pour mes savons, de cette façon).
(mais bon, revenons à nos moutons chimiques, dis. Tu ne t'en sortiras pas en me faisant parler de mon parcours professionnel, non mais!)
Alors.
Aujourd'hui, je voulais vous poser une question. Sur les savons (pour commencer).
Les savons ont un pH basique, ça tu le sais... Et tu sais aussi qu'un pH est basique parce qu'il a une valeur supérieure à celle de la neutralité. C'est-à-dire supérieure à 7.
Jusqu'ici pas de problème...
* Acide < 7 * Neutre = 7 * Basique > 7
Mais si je te demande POURQUOI un pH neutre est égal à 7, là... C'est moins évident.
Cette valeur de 7, finalement, c'est quoi?
Pour répondre à la question, il faut reprendre certaines des bases de la chimie physique...
1/ L'eau pure est neutre: pourquoi?
Vous savez probablement qu'il existe dans l'eau pure, qui est totalement neutre électriquement, un équilibre acidobasique dans lequel l'eau, composé dit "amphotère", joue les 2 rôles:
rôle d'acide: H20 OH- + H+ (elle cède des ions H+)
rôle de base: H2O + H+ H3O+ (elle capte des ions H+)
bilan: 2 H2O OH- + H3O+
* L'eau capte autant d'ions H+ qu'elle en cède, l'équation est neutre *
2/ Neutralité, acidité, basicité: le rapport avec [H+]
Sachant que ce sont les ions (donc les espèces + et -) qui conduisent l'électricité dans une solution, et qu'une solution neutre a autant d'ions positifs que négatifs, on peut remonter à la concentration ionique en mesurant la conductivité électrique.
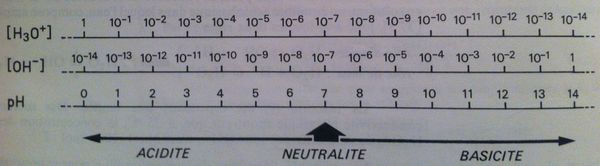
Ainsi, dans l'eau pure à 25°C, on calcule (après mesure électrique) une concentration des ions H+ et OH- égale à 10-7 mol/l. Autrement dit, c'est très peu... Mais tu commences à comprendre d'où vient le fameux 7 dont on parlait tout à l'heure... ;-)
De façon générale, on a constaté que les deux variables [OH-] et [H+] (aussi appelé [H3O+]) sont reliées entre elles... Si l'une augmente, l'autre diminue, d'après l'équation chimique précédemment citée.
Ainsi :
* lorsqu'une solution est neutre, on peut dire que [OH-] = [H3O+] = 10-7
* lorsqu'une solution est acide, elle est chargée électriquement : la concentration en ions H3O+ (appelés aussi H+) devient majoritaire. L'équilibre ionique n'est plus maintenu. [OH-] < [H3O+].
* de même, une solution basique est chargée négativement en ions OH-, et l'équilibre ionique est là encore déplacé. [OH-] > [H3O+].
Conclusion: pour simplifier les choses, on ne parlera que de [H3O+], puisque les 2 valeurs sont liées. Et la force de l'acidité d'une solution dépend de sa concentration en [H+].
3/ Quest-ce que le pH, alors?
Dans les solutions aqueuses, la valeur de [H3O+] peut varier énormément (de quelques unités à 10-15 mol/l environ). Aussi utilise-t-on souvent une échelle logarithmique plus commode, en définissant une nouvelle grandeur : le pH! Ainsi : pH = -log [H+]
* Le pH de l'eau pure vaut donc, à 25°c :
-log [H3O+] = -log [10-7] = 7 !! (CQFD)
On peut ainsi représenter une échelle des concentrations ioniques et du pH pour les solutions aqueuses de ce type:
4/ Et pourquoi pas "moins que zéro" ou "plus que 14"?
L'échelle des pH est usuellement limitée aux valeurs extrêmes 0 et 14. Dans des solutions concentrées d'acide et de base très fortes, le pH pourrait être 14 , mais l'échelle logarithmique dans laquelle le pH est défini réduit les possibilités de dépassement des limites 0 et 14...
D'autre part, dans de telles concentrations, les approximations faites dans la définition du pH ne seraient plus valides, et l'activité de l'eau-solvant ne pourrait plus être assimilée à celle d'un liquide pur!
Hop! Toujours là?
Bravo! Vous êtes donc courageux... Mais vous savez à présent ce qu'est le pH ! ;-)










/http%3A%2F%2Fstorage.canalblog.com%2F44%2F55%2F818878%2F97443973_o.jpeg)
/http%3A%2F%2Fstorage.canalblog.com%2F44%2F57%2F818878%2F66821644_o.jpg)
/http%3A%2F%2Fstorage.canalblog.com%2F90%2F93%2F818878%2F63270377_o.jpg)
/http%3A%2F%2Fstorage.canalblog.com%2F38%2F98%2F818878%2F62808153_p.jpg)
/https%3A%2F%2Fprofilepics.canalblog.com%2Fprofilepics%2F1%2F0%2F103293.jpg)