21 avril 2011
La chimiste du coin vous répond: où est passé le sodium, ou l'équation-bilan qui démystifie le savon...
Bon, cette photo a plus de 10 ans et j'étais encore blonde à l'époque. Le tout est de savoir LAQUELLE des 3 blondes je suis... Na. Qui a dit que la couleur de cheveux déterminait les prédispositions aux sciences? hein? Comment ça, c'est moi? ;-)
Je répondais à Raphaël, qui me demandait où pouvait bien passer le sodium contenu dans la soude lors de la réaction de saponification...
Et puis je me suis dit que ça serait peut-être pas mal que de copier ma réponse ici, au cas où l'info puisse renseigner d'autres personnes qui pourraient se poser la même question...
Par contre, il va falloir écrire une ou deux équations-bilans (attention au mal de tête!) ;-)
Allez, c'est parti!
En fait, le savon est crée à partir d’une réaction entre deux réactifs : du triglycéride (qui contient 3 acides gras R1 R2 et R3) et un alcali (la soude ou la potasse, mettons qu'on parle ici de la soude NaOH).
Voilà l'équation qui reprend la réaction, la première espèce chimique étant le triglycéride:
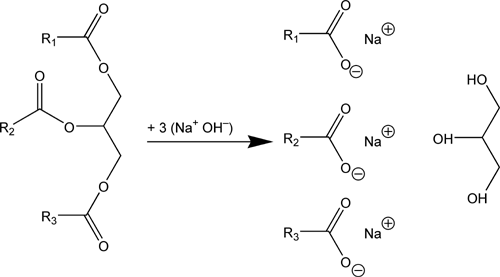
On peut la réécrire sous cette forme:
R-COO-R' + Na+HO– → R-COO– Na+ + HO-R'
Soit: huile + alcali = savon + glycérine
On parle ici de Na+OH-.
En fait, c'est la formule du NaOH lorsqu'il est dissout dans l'eau: il forme les ions Na+ et OH-. Les ions ne sont pas des espèces "visibles" que l'on peut "toucher": il s'agit de molécules dispersées dans de l'eau, solubilisées.
Ainsi, si l’on dissout du NaOH, il forme dans l’eau du NA+ HO-.
L’ion Na+ va alors réagir avec un acide gras pour former le savon : R-COO-Na+.
L’ion Na+ va alors réagir avec un acide gras pour former le savon : R-COO-Na+.
On fait figurer dans l'équation-bilan les espèces + et - pour montrer que l'on est bien en équilibre électrique, mais l'espèce obtenue est un solide (donc une espèce non ionique, en équilibre électrique et neutre électriquement parlant: le RCOO-Na+, que l'on peut également noter RCOONa puisque le + du Na "annule" le - du OH-).
CQFD! Le savon est une espèce qui contient du sodium!
Et s'il n'est pas salé au goût (meuh non, je ne mange pas du savon au déjeuner, pfff... Je fais parfois des tests "sur la langue" pour voir si le savon est caustique ou pas - si oui: il picotte les papilles...), donc s'il n'est pas salé disais-je, c'est tout simplement parce que le sel c'est du chlorure de sodium. NaCl.
Et qu'il n'y a pas de chlore dans le savon!
Trop facile, non?
Hop!
Publicité
Publicité
Commentaires
M
K
C
C
R





/http%3A%2F%2Fstorage.canalblog.com%2F13%2F53%2F676983%2F47108733_p.jpg)
/https%3A%2F%2Fassets.over-blog.com%2Ft%2Fcedistic%2Fcamera.png)
/http%3A%2F%2Fstorage.canalblog.com%2F50%2F89%2F818878%2F115551492_o.png)
/http%3A%2F%2Fstorage.canalblog.com%2F61%2F84%2F818878%2F96321402_o.jpg)
/https%3A%2F%2Fprofilepics.canalblog.com%2Fprofilepics%2F1%2F0%2F103293.jpg)